王会龙,阮东丽,刘克普,韦亨,武国军,张更,李智斌(.西安市人民医院(西安市第四医院)泌尿肾脏病院,陕西 西安 70004;
.空军军医大学西京医院泌尿外科,陕西 西安 70000)
20 世纪70 年代我国开展器官移植以来,器官移植手术已经成为治疗器官终末期功能衰竭的有效手段之一,公民逝世后器官捐献成为我国器官移植的主要来源[1-2]。而供体器官短缺使得许多肾移植中心逐渐重视扩大标准供体(expanded criteria donor,ECD)供肾的评估和利用,以减少供肾的废弃,扩大供体库,使更多的终末期肾病患者获得肾移植的机会[3]。现回顾性分析2014 年2 月至2022 年2 月在空军军医大学第一附属医院接受移植且在空军军医大学第一附属医院和西安市人民医院泌尿肾脏病院两家中心规律随访的ECD 肾移植和标准供肾(standard criteria donors,SCD)肾移植受体的临床资料,总结ECD 供肾的评估和维护经验,提高ECD 供肾的移植效果。
1.1 研究对象与分组:回顾性分析2014 年2 月至2022 年2 月在空军军医大学西京医院接受移植且在西京医院和西安市人民医院泌尿肾脏病院两家中心规律随访肾移植患者90 例的临床资料,其中ECD 肾移植31 例,SCD 肾移植59 例。ECD 组纳入标准:供体年龄≥60 岁,或年龄在50 ~59 岁之间且符合以下至少两项标准:终末血肌酐(serum creatinine,Scr)>133 μmol/L、脑血管意外作为死因、高血压病史[3]。所有供体和受体均签署知情同意书,手术均符合医学、伦理学的相关标准。
ECD 组受体31 例,其中女性8 例,男性23 例,平均年龄为(41.61±12.15)岁,SCD 组受体59 例,其中女性9 例,男性50 例,平均年龄为(39.2±9.8)岁,ECD 组所有受体群体反应性抗体(panel reactive antibody,PRA)均<10%,SCD 组中PRA <10%为55 例,10%~30%为4 例。两组供体与受体一般状况详见表1。

表1 ECD 组与SCD 组供体与受体一般状况
1.2 供体维护与供受体选择:根据《中国公民逝世后捐献供器官功能评估和维护专家共识》和《中国移植器官保护专家共识》对供体进行病情和器官功能评估和维护,监测供体的生命体征、生化化验、血流动力学以及尿量等各项指标,并改善供体全身状况,必要时使用体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)维持循环及供氧[4-5]。采用腹部多器官联合切取术式获取供器官,所有供肾均采用单纯低温静置保存,热缺血时间为115 ~200 s,冷缺血时间为2 ~8 h。
参考供体及供肾的评估结果,结合供、受体HLA 配型、PRA、年龄、体重、透析情况和供体器官功能等指标,根据中国人体器官分配与共享计算机系统合理选择受体。供、受体均符合ABO 血型相容原则,淋巴细胞毒交叉配合试验均<10%,受体HLA 错配数为1 ~5 个。常规进行肾移植手术,所有移植手术均为单肾移植。
1.3 围术期免疫抑制方案:免疫诱导方案:① 兔抗人胸腺细胞免疫球蛋白(50 mg/d,d 0 ~d 2 或者50 mg,d 0;
25 mg,d 1 ~d 4)+注射用甲泼尼龙琥珀酸钠(750 mg,d 0;
500 mg,d 1;
250 mg,d 2;
120 mg,d 3)。② 巴利昔单抗 (20 mg,d 0 ~d 4)+注射用甲泼尼龙琥珀酸钠(750 mg,d 0;
500 mg,d 1;
500 mg,d 2;
250 mg,d 3;
120 mg,d 4)。
免疫治疗方案:常规选择三联免疫抑制治疗:吗替麦考酚酯(mycophenolate mofetil,MMF)/麦考酚钠肠溶片(mycophenolate sodium enteric-coated tablets,EC-MPS)、环孢素(cyclosporine A,CsA)/他克莫司(tacrolimus,Tac)、甲泼尼龙。其中MMF的起始用量为1.5 ~2 g/d,EC-MPS 的起始用量为1080 ~1440 mg/d;
CSA 的起始用量为4.5 ~5.0 mg/(kg·d),Tac 起始用量为0.1 ~0.2 mg/(kg·d),根据CsA 和Tac 的血清药物谷浓度调整用量,CsA 术后1、3、6 个月的目标谷浓度分别为230 ~250 ng/ml,180 ~200 ng/ml、150 ~180 ng/ml。Tac 术后1、3、6 个月的目标谷浓度分别为10 ~12 ng/ml、7 ~8 ng/ml、5 ~7 ng/ml。甲泼尼龙在静脉用药结束后改为口服,起始剂量为48 mg/d,每日减量4 mg,术后3 个月左右维持2 ~4 mg/d。
1.4 观察指标与随访:观察两组术后5 年内的Scr水平,急性排斥反应(acute rejection,AR)和肾功能延迟恢复(delayed graft function ,DGF)的发生情况,术后感染性并发症、持续性蛋白尿以及其他并发症的发生率等指标,比较两组术后5 年内人、肾存活率。
AR 根据患者术后的尿量、Scr 恢复情况、移植肾B 超及移植肾病理穿刺活检综合判断。AR 治疗方案:注射用甲泼尼龙琥珀酸钠激素冲击治疗3 ~4 d 或兔抗人胸腺细胞免疫球蛋白50 mg/d,3 ~5 d。术后感染性并发症以感染部位、相关化验结果、病原学和影像学检查等综合判断。DGF诊断标准:肾移植术后7 d 内需要血液透析[3]。
1.5 统计学方法:采用SPSS 20.0 软件进行统计学处理,正态分布的计量资料以均数±标准差(±s)表示,比较采用t 检验,非正态分布的计量资料以中位数(最大值~最小值)表示,采用秩和检验。计数资料以百分数(%)表示,比较采用χ2检验。以P <0.05 为差异有统计学意义。
2.1 移植肾功能情况:ECD 组和SCD 组的受体在术后第1 个月、3 个月、6 个月、1 年、2 年、3 年及5 年Scr 水平详见表2,术后1 个月、3 个月、6 个月、1 年、2 年、3 年及5 年的Scr 水平均ECD组高于SCD 组,两组间有显著性差异,但ECD 组5 年内的Scr 水平均小于200 μmol/L。ECD 组发生原发性移植肾无功能(primary non-function,PNF)2 例,而SCD 组未发生PNF。
表2 ECD 组与SCD 组受体Scr 水平(μmol/L,±s)

表2 ECD 组与SCD 组受体Scr 水平(μmol/L,±s)
组别术后时间1 个月3 个月6 个月1 年2 年3 年5 年ECD224.4±133.5168.6±54.7178.1±102.8160.6±60.3159.6±53.0144.5±79.2182.3±86.4 SCD168.3±81.7133.5±44.3118.8±49.9125.3±39.4125.4±35.4113.8±35.0127.9±53.3 t 2.43.33.63.33.72.53.7 P 0.020.001<0.050.001<0.050.01<0.05
2.2 术后并发症发生情况:ECD 组AR 发生率为12.9%(4/31),分别发生于术后1 周、2 周、4 个月及9 个月,SCD 组AR 发生率为18.6%(11/59),其中9 例发生在术后1 个月内,另2 例分别发生于术后3 个月、10 个月,AR 在治疗后肾功能均明显好转(表3)。两组AR 发生率差异无统计学意义(χ2=0.48,P >0.05)。

表3 ECD 组与SCD 组受体并发症发生情况〔例(%)〕
ECD 组DGF 发生率为22.6%(7/31),其中2 例为PNF,另5 例经过治疗后均逐渐恢复。SCD组DGF 发生率为16.9%(10/59),10 例DGF 均在术后1 个月内恢复。两组DGF 发生率差异无统计学意义(χ2=0.42,P >0.05)。
ECD 组肺部感染发生率为12.9%(4/31),其中3 例发生于术后1 年内,1 例术后4 年且因肺部感染死亡。SCD 组肺部感染发生率6.8%(4/59),3 例发生于术后3 个月内,1 例发生于术后5 年,均治疗无效死亡。两组肺部感染发生率差异无统计学意义(χ2=0.34,P >0.05)。ECD 组其他感染发生率为25.8%(8/31),SCD 组其他感染发生率为15.3%(9/59),无显著性差异(χ2=1.48,P >0.05)。ECD 组术后持续性蛋白尿1 年以上发生率为22.6(7/31),SCD 为15.3%(9/59),无显著性差异(χ2=0.510,P >0.05)。
ECD 组其他并发症的发生率为19.4%(6/31),其中2 例为移植肾周血肿,分别行移植肾探查血肿清除术、超声引导下移植肾周血肿穿刺引流术,术后再次复查血肿逐渐消失。1 例于术后4 d 时发生移植肾血栓,术中探查切除移植肾,恢复血液透析治疗。1 例发生移植肾假性动脉瘤破裂,术中探查切除移植肾,恢复血液透析治疗。1 例发生泌尿系结石,保守治疗。1 例发生漏尿,二次手术治疗,术后恢复良好。SCD 组其他早期并发症发生率为10.2%(6/59),1 例于术后1 d 超声显示移植肾动脉无血流,行移植肾探查并重新灌注移植肾后明显好转。1 例移植肾周血肿,1 例漏尿,1 例淋巴瘘,再次手术治疗均治愈。1 例术后3 个月时发生白细胞减少症,给予对症治疗后明显好转,1 例术后2 年时发生脑血管意外死亡。两组其他并发症发生率无显著性差异(χ2=0.8,P >0.05)。
2.3 长期随访及人/肾存活率(图1):两组受体均长期规律随访。ECD 组1、2、3、4、5 年人/肾存活率分别为93.5/90.3、93.5/83.9、90.3/83.9、87.1/80.6、87.1/77.4,SCD 组1、2、3、4、5 年人/肾存活率分别为91.5/93.2、89.8/91.5、89.8/91.5、89.8/91.5、88.1/89.8,肾存活率ECD 组略低于SCD组,但两组差异无统计学意义(P >0.05)。
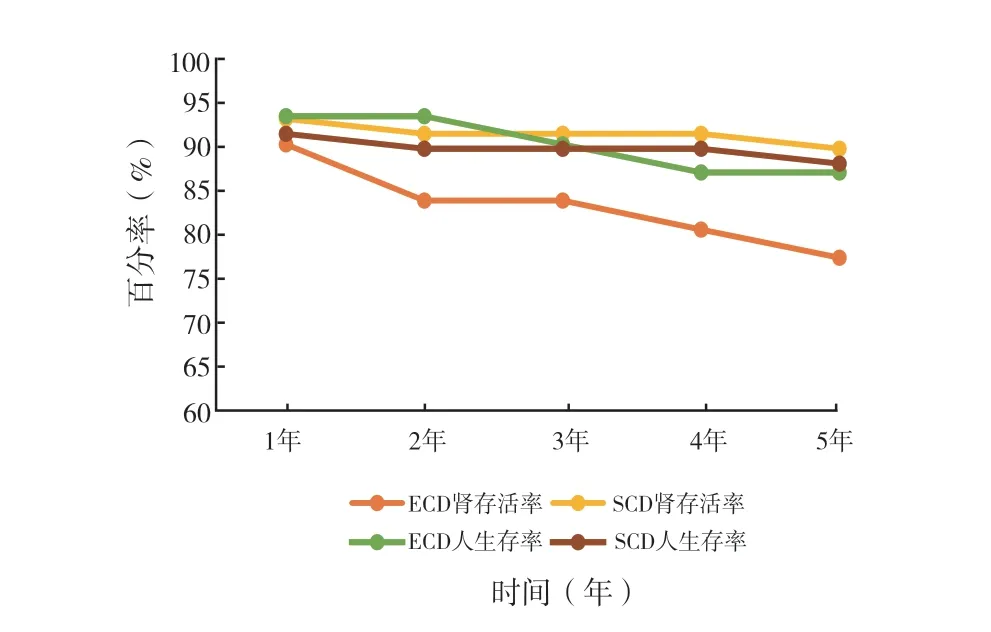
图1 ECD 组与SCD 组人/肾存活率
由于器官短缺和老龄化的原因,使得近年来不同国家/地区的ECD 移植数量有所增加,从而缩短了肾移植的等待名单[6]。更多的研究证实ECD作为新的供体器官来源解决供体短缺问题已被证明是一个合理的方案,尽管供肾受损风险高于SCD,但与继续透析的患者相比其总体存活率有所提高,生活质量也有一定改善。而也有研究显示,ECD供肾移植失败的相对风险高于SCD,5 年的ECD供肾丢失率约50%[7]。Rachel 等[8]研究显示与透析相比,老年患者SCD 移植可能获得生存益处,但ECD 移植与透析相比生存益处较小。本研究中ECD 组1 个月、3 个月、6 个月、1 年、2 年、3 年及5 年的Scr 均高于SCD 组,可见SCD 肾功能恢复是要优于ECD,但两组术后5 年内Scr 均值低于200 μmol/L,ECD 供肾移植5 年人/肾存活率为87.1%/77.4%,可见ECD 供体肾移植与SCD 相比,是能够取得一定的临床效果的,可以作为扩大供肾来源的一种有效途径,但长期临床效果仍略差于SCD。
ECD 肾移植有较高的DGF 发生率,DGF 是同种异体移植丢失和死亡的危险因素,其长期存活率与SCD 相似或仅略低,因此使用ECD 供肾移植时需要重视手术和冷缺血时间的优化[6,9]。ECD 肾移植的移植物丢失率高于SCD,大约五分之一的ECD 肾脏移植发生早期移植物丢失[10]。韩国一项研究显示已故的捐助者中,31.2%是扩大标准的捐助者,由于ECD 供肾年龄较大,肾脏修复损伤的能力受损可能导致排斥的风险更高[11]。本项研究中ECD 组AR 的发生率与SCD 组无显著性差异,ECD 组发生2 例PNF,而SCD 组并未出现PNF,ECD 组DGF 发生率虽高于SCD 组,但无显著性差异,与相关文献报道不符,可能与研究样本量少有关。ECD 组各有1 例移植肾血栓和假性动脉瘤而导致移植肾丢失,可能与ECD 组供受体年龄偏大、血管条件差有关。
在ECD 肾移植受体中,MDR 细菌感染的发生率较高,死亡的主要原因是感染[12]。在本研究中ECD 组与SCD 组比较,肾移植受体肺部感染、其他感染、持续性蛋白尿及其他并发症发生率差异均无统计学意义,与相关文献报道不完全相符,可能是由于样本量偏少,需继续随访并扩大研究对象,以得到更精确的结论。
目前临床有多个评分系统,如Nyberg 评分、Anglicheau 评分、Schold 评分及肾脏供体风险指数(kidney donor risk index,KDRI)、肾脏供体概况指数(kidney donor profile index,KDPI)等应用于肾移植,每个评分系统都有各自的优缺点,目前很难获得一个统一的评分标准[3]。KDRI 和KDPI 更多的用于ECD 肾脏供体评估,KDRI 越高,供体质量越低,KDPI 越高,预期的移植物存活率越短,KDRI 和KDPI 值越低,供体质量和预期的移植物寿命越高[13]。利用KDPI 和植入前肾活检评估ECD,植入前活检中高KDPI 和较重的组织损伤,尤其是肾小球和血管病变,与较高的ECD 移植肾丢失率有关,建议在移植前评估KDPI 高的ECD 时,应同时考虑临床和组织学变量[14]。移植前肾脏穿刺活检供肾病理判定是评估ECD 供肾质量的有效手段[15]。而增加移植前穿刺活检组织病理学特征和深度学习HE 染色整个切片病理图像可提高移植肾功能预测的准确性,同时将动态预测模型纳入供受体电子健康记录可以及时减轻ECD 移植物失败的风险[16-17]。
但也有研究显示不应过分强调KDRI,而将机械灌注技术应用于ECD,DGF 的发生率有所改善,但早期移植物丢失的发生率并没有显著降低[10]。目前多数移植中心常规使用Lifeport 对供肾进行保存、运输及质量评估。普通人群的老龄化导致次优肾脏的使用增加,ECD 肾脏移植效果较差,且移植肾的即刻功能低下,常温机器灌注(normothermic machine perfusion,NMP)可改善整体的预后,低温机器灌注同时也可改善即刻肾功能恢复[18]。越来越多的证据表明,ECD 在移植过程中将受到更强的缺血/再灌注损伤,而机器灌注加骨髓间充质干细胞在提高ECD 器官质量方面更具优势[19-20]。无缺血肾移植(ischemia-free kidney transplantation,IFKT)手术可避免了供肾出现缺血/再灌注损伤,能够降低术后DGF 和AR 发生的风险,提高ECD供肾利用率[21]。
目前的主流观点倾向于将ECD 肾脏分配给年龄较大的接受体[22]。因此,我们对ECD 供肾的分配策略是选择HLA 错配位点少、DSA 及PRA 低、高龄、低体重的受体,尽量减少冷缺血时间,减少ECD 供肾的不良因素,从而提高移植肾的存活率。但ECD 供肾在临床实践中仍存在的伦理风险,我们需要用医学专业知识和伦理道德来尽力维护患者的健康和生命,在尊重其自主性,提供清晰、标准化和透明的信息以及信任医生的情况下,让患者可以接受不太理想的肾脏进行移植,这应该是更成功使用ECD 肾脏的关键原则[23]。
总之,ECD 供肾的使用虽然扩大了供肾来源且短期能获得一定的临床效果,但长期来看仍然略差于SCD,如何精确评估和进一步维护ECD 供肾的功能,突破伦理和技术层面的局限,仍需要更多中心的前瞻性研究来探讨。
猜你喜欢移植物供体存活率本刊常用的不需要标注中文的缩略语(二)实用器官移植电子杂志(2021年3期)2021-11-30园林绿化施工中如何提高植树存活率建材发展导向(2021年11期)2021-07-28损耗率高达30%,保命就是保收益!这条70万吨的鱼要如何破存活率困局?当代水产(2020年10期)2020-03-17水产小白养蛙2年,10亩塘预计年产3.5万斤,亩纯利15000元!存活率90%,他是怎样做到的?当代水产(2019年8期)2019-10-12不同氢供体对碳纳米管负载钯催化剂催化溴苯脱溴加氢反应的影响当代化工研究(2016年7期)2016-03-20表现为扁平苔藓样的慢性移植物抗宿主病一例实用皮肤病学杂志(2015年4期)2015-12-22高龄供体的肝移植受者生存分析实用器官移植电子杂志(2015年1期)2015-04-02终末热灌注对心脏移植术中猪供体心脏的保护作用郑州大学学报(医学版)(2015年2期)2015-02-27一些含三氮杂茂偶氮染料O,N供体的Zr(Ⅱ)配合物的合成、表征和抗微生物活性无机化学学报(2014年5期)2014-02-28Alice台风对东海鲐鱼鱼卵仔鱼的输运和存活率的影响中国海洋大学学报(自然科学版)(2014年8期)2014-02-28


